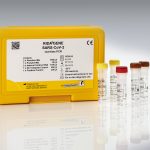
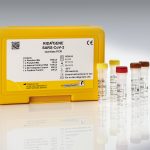
Verwendungszweck:
Für die in-vitro Diagnostik. Der RIDA®GENE SARS-CoV-2 Test, der auf dem Roche LightCycler® 480II durchgeführt wird, ist eine multiplex real-time RT-PCR zum direkten qualitativen Nachweis der Coronavirus (SARS-CoV-2) RNA aus humanem Nasen-/Rachenabstrich von Personen mit Anzeichen und Symptomen einer respiratorischen Infektion.
Der RIDA®GENE SARS-CoV-2 Test ist zur Unterstützung der Differentialdiagnose von SARS-CoV-2-Infektionen bei Patienten mit Symptomen einer respiratorischen Infektion in Verbindung mit anderen klinischen Befunden und Laborbefunden vorgesehen.
Negative Ergebnisse schließen eine Infektion mit SARS-CoV-2 nicht aus und sollten nicht als alleinige Grundlage für die Diagnose herangezogen werden.
Das Produkt ist für den Einsatz durch Fachanwender in Krankenhauslaboren, Referenzlaboren, Privatlaboren oder staatlichen Laboren vorgesehen.
Der RIDA®GENE SARS-CoV-2 multiplex real-time RT-PCR Test ist kompatibel für die Verwendung auf folgenden real-time PCR-Geräten: LightCycler® 480II, RIDA®CYCLER, Mx3005P, ABI 7500 Fast Dx, CFX96™ Dx, Rotor-Gene Q.
Sollten Sie weitere real-time PCR-Geräte verwenden wollen, kontaktieren Sie bitte R-Biopharm AG zur Überprüfung der Kompatibilität unter mdx@r-biopharm.de.
PG6815/PG6820: Nicht verfügbar in Nordamerika
PG6820: Nur verfügbar innerhalb der EU/EFTA
Detektiert auch die neue Omikron Variante (B1.1.529)!
Allgemeines:
Ende Dezember traten in Wuhan, einer Metropole Chinas, eine Vielzahl von Lungenentzündungen mit unklarer Ursache auf. Anfang Januar konnte von chinesischen Behörden ein neuartiges Coronavirus (SARS-CoV-2) als Ursache dieser Erkrankungen identifiziert werden. Die durch SARS-CoV-2 ausgelöste Krankheit erhielt den offiziellen Namen COVID-19 („Corona Virus disease 2019“) und ist von Mensch zu Mensch übertragbar.
Weltweit wurden bereits 3.925.815 Fälle gemeldet (Stand: 10.05.2020). Erste Fälle sind seit Ende Januar 2020 auch in Deutschland bestätigt worden. Deutschlandweit wurden bereits 169.575 Fälle gemeldet (Stand: 11.05.2020). Die WHO hat am 31.01.2020 einen internationalen Gesundheitsnotstand ausgerufen.
In den ursprünglichen Leitlinien der WHO wird eine Drei-Target Strategie empfohlen. Als diese Leitlinie erstellt wurde, lagen nicht genügend Sequenzinformationen für SARS-CoV-2 vor, sodass die von der WHO veröffentlichten Sequenzbereiche einzeln in den Target-Genbereichen nicht spezifisch genug für die Detektion von SARS-CoV-2 RNA waren. Um die Spezifität der Tests für SARS-CoV-2 zu erhöhen wurde dementsprechend eine Drei-Target Strategie verfolgt. Am 17. Januar 2020 wurde diese Drei-Target Strategie auf eine Zwei-Target Strategie reduziert, da das dritte Target eine unzureichende Sensitivität aufwies.
Am 17. März 2020 gab die WHO vorläufige Leitlinien für die Diagnostik von Verdachtsfällen bei einer, durch SARS-CoV-2 verursachten, Coronavirus-Erkrankung (COVID-19) in Hinblick auf die Anforderungen für molekularbiologische Laborteste heraus, in denen es heißt: „In Gebieten, in denen das COVID-19-Virus weit verbreitet ist, wird die Verwendung eines einfacheren Algorithmus wie beispielsweise der Detektion eines einzelnen spezifischen SARS-CoV-2 Targets (Ein-Target Strategie) mittels real-time RT-PCR als ausreichend angesehen.“
Die R-Biopharm AG hat bei der Entwicklung des RIDA®GENE SARS-CoV-2 real-time RT-PCR Assays von Beginn an die Ein-Target Strategie verfolgt. Unser Ziel war es einen sensitiven und spezifischen SARS-CoV-2 Nachweis mit optimierten Workflow, d.h. ohne weitere notwendige Bestätigung zu etablieren. Dies war zu diesem Zeitpunkt bereits möglich da eine Vielzahl von Genomsequenzen des neuartigen Coronavirus SARS CoV-2 zur Verfügung standen. Im Rahmen von Genomanalysen konnten wir einen Bereich innerhalb des E-Gens identifizieren, welcher spezifisch für SARS-CoV-2 ist. Dieser Bereich liegt etwa 200 Basenpaare downstream von dem WHO publizierten unspezifischen Bereich des E-Gens von SARS-CoV-2. Durch den Nachweis dieses spezifischen E-Genbereichs konnte die R-Biopharm AG dementsprechend die Detektion von SARS-CoV-2 RNA auf nur ein Target reduzieren.
Image Gallery
| Art. Nr. | PG6815 / PG6820 |
|---|---|
| Testformat | PG6815: Real-time PCR mit 100 Reaktionen PG6820: Real-time PCR mit 200 Reaktionen |
| Haltbarkeit | 24 Monate nach Produktion |
Liebe Kunden,
wir haben damit begonnen, die Dokumente zu unseren Produkten in einem elektronischen Format bereitzustellen. Hierbei handelt es sich um die Gebrauchsanweisung (IFU), die Sicherheitsdatenblätter (SDS) sowie das Certificate of Analysis (CoA). Für Chargen, die ab dem 01. Januar 2023 in Verkehr gebracht wurden, finden Sie unsere Dokumente auf dem eIFU Portal eifu.r-biopharm.com/clinic.